肿瘤精准药物治疗研究进展 | 科技导报
- 机械智慧
- 2024-12-02 14:17:26
- 47

肿瘤精准药物治疗概述肿瘤是高度异质性疾病,同一种恶性肿瘤在不同患者个体间从基因型到表型都存在差异,这种差异导致同类型的癌症患者对药物的反应性各异。随着基因测序费用持续下降,以及癌症基因组图谱计划等大型......
肿瘤精准药物治疗概述
肿瘤是高度异质性疾病,同一种恶性肿瘤在不同患者个体间从基因型到表型都存在差异,这种差异导致同类型的癌症患者对药物的反应性各异。随着基因测序费用持续下降,以及癌症基因组图谱计划等大型组学项目宣告完成,引起抗肿瘤药物反应个体差异的相关基因不断被发现和证实,为抗肿瘤精准药物的开发奠定了坚实的基础。
1998年开始,美国食品药品监督管理局(FDA)陆续批准曲妥珠单抗、伊马替尼、吉非替尼、维罗非尼等抗肿瘤精准药物。这些药物的成功上市,不仅提高了抗肿瘤药物对特定肿瘤人群的治疗效率,还减少了医疗资源浪费,给肿瘤患者带来新的治疗选择。
随着肿瘤精准治疗理念的不断更新,靶向精准治疗药物开发日新月异。近年来,一些新兴的抗肿瘤精准药物也取得了突破性的进展。

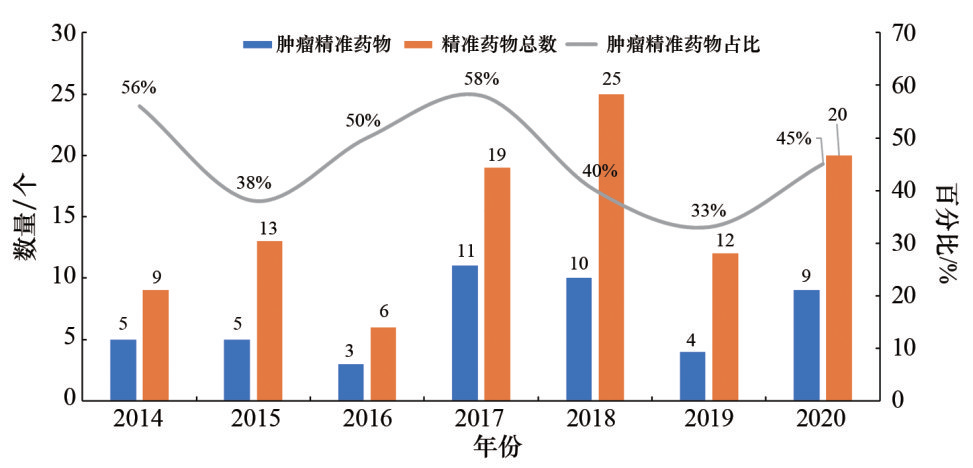
2014—2020年FDA批准的抗肿瘤精准药物数量
获批上市的抗肿瘤精准靶向药物
除了研发进展较快的嵌合抗原受体T细胞(CAR-T)免疫疗法,近年来获批上市的抗肿瘤精准药物主要指精准靶向药物。抗肿瘤精准靶向药物获批的适应症较多,主要集中于非小细胞肺癌(NSCLC)、慢性髓系白血病(CML)、乳腺癌、卵巢癌、前列腺癌、急性髓系白血病(AML)以及黑色素瘤等。
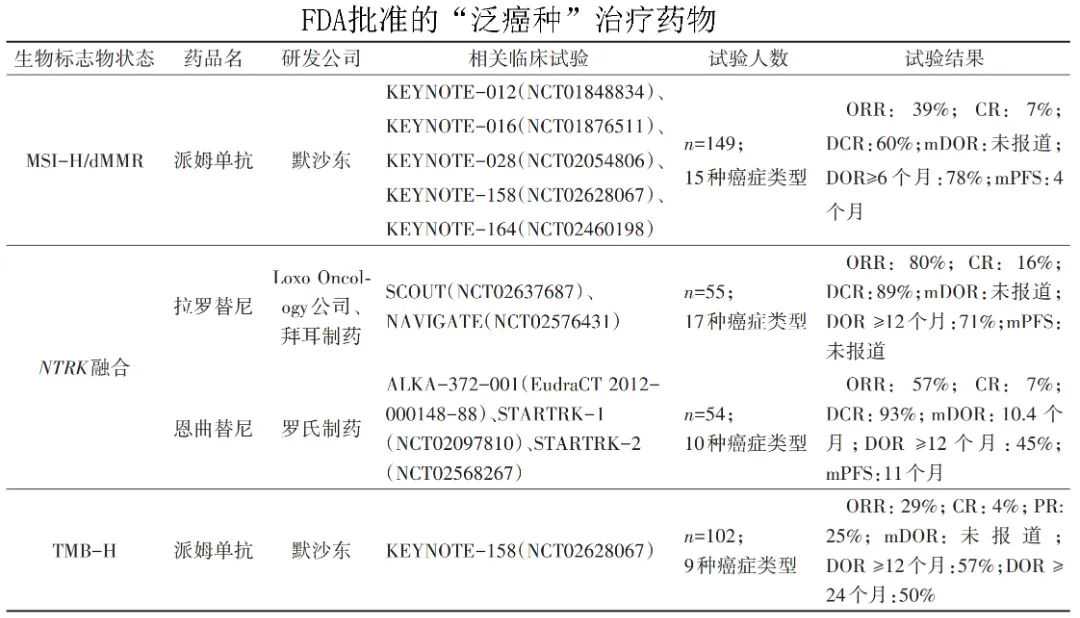
根据近5年获批的药物数量,精准靶向药物研发在NSCLC和AML的治疗中进展相对较快。
NSCLC是抗肿瘤精准药物研发最为深入的领域,随着表皮生长因子受体(EGFR)抑制剂在临床上取得了优异的治疗效果,研究人员意识到NSCLC在分子水平上是一种高度异质性疾病,NSCLC患者通常存在多种驱动基因突变,每一种基因突变都有可能成为新的治疗靶点。
对每一位新诊断的晚期NSCLC患者进行生物标志物检测,进而指导用药已经成为共识;大量数据表明,精准靶向药物显著提高了NSCLC患者整体存活率,部分晚期NSCLC患者的中位生存期也已经从几个月延长至3年以上。
AML是一组高度异质性的克隆性疾病,合理的分子分型体系可为AML的个体化分层治疗及预后评估提供重要参考。在精准靶向药物出现之前,AML是药物治疗研究进展最缓慢的血液肿瘤之一。2017年至今,FDA连续批准了7个AML药物,其中包括5个精准靶向药物,分别为2个异柠檬酸脱氢酶(IDH)抑制剂和3个Fms样酪氨酸激酶3(FLT3)抑制剂。
伴随抗肿瘤精准药物发展的新理念与新技术
抗肿瘤精准药物发展催生“泛癌种”治疗药物
2017年5月,FDA加速批准派姆单抗(pembrolizumab)用于无法手术切除或发生转移的高度微卫星不稳定性(MSI-H)和错配修复缺陷(dMMR)的成人和儿童实体瘤患者。派姆单抗是FDA批准的首个基于肿瘤标志物而非基于肿瘤起源部位的抗癌药物,也是抗肿瘤精准治疗发展史上的里程碑事件。截至2021年6月,FDA已经批准4项“泛癌种”治疗适应症。
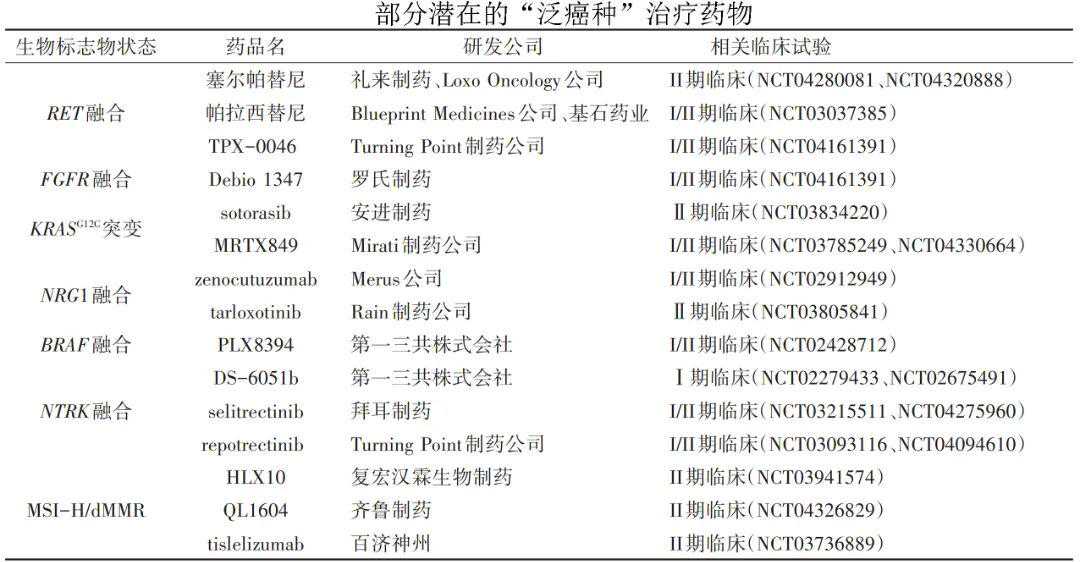
注:CR:完全缓解;PR:部分缓解;mDOR:中位缓解持续时间;mPFS:无进展生存期。
尽管当前获批的“泛癌种”治疗药物涉及的生物标志物在多数癌症患者中的突变频率相对较低,但这些药物可以给一些罕见癌症患者带来新的治疗选择。研究报道,NTRK融合突变在许多常见癌症(例如肺癌、黑色素瘤、乳腺癌等)中比较罕见,发生率不足1%,但在某些罕见肿瘤中突变率超过90%,包括婴儿肉瘤、唾液腺癌和分泌型乳腺癌等。
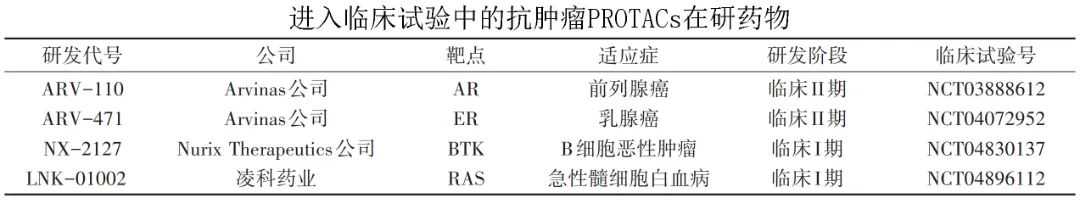
下表列出了部分潜在的“泛癌种”治疗药物,其中包括部分针对耐药的二代原肌球蛋白受体激酶(TRK)抑制剂(selitrectinib、repotrectinib、DS-6051b),相关临床试验正在进行中。
新型临床试验设计加速抗肿瘤精准药物开发
精准药物的发展催生新的临床试验方案设计,即根据患者的肿瘤基因组信息制定治疗方案或根据预后生物标志物调整治疗方案。随着对治疗反应性和耐药性生物标志物的研究不断深入,研究人员对抗肿瘤药物的临床试验设计更加多样化,从而使患者个体与合适的治疗方案精准匹配。
基于生物标志物的临床试验设计可以减少试验所需样本量,降低不良事件的发生率,提高药物研发的成功率,并加快临床开发速度。有研究表明,在临床试验中利用生物标志物对患者分层可将抗肿瘤药物研发成功率(从临床I期到获批上市)提高至10.7%,而未使用生物标志物的抗肿瘤药物临床试验成功率仅为1.6%。
2018年9月,FDA发布指南文件重点讨论临床试验适应性设计和抗肿瘤药物临床试验的主方案。该方案囊括了“篮子试验”“雨伞试验”以及“平台试验”,框架主要为“使用同一个基础设施、试验设计和研究方案,在多项子研究中对多种药物和/或疾病人群同时进行评价,从而提高药物开发的效率”。
“篮子试验”和“雨伞试验”对加速肿瘤精准治疗药物的开发和临床肿瘤学的发展具有重要意义。“篮子试验”旨在用同一种方法治疗相同基因突变导致的不同组织的疾病,其本质是一种药物对应不同的疾病或疾病亚型。TRK抑制剂拉罗替尼和恩曲替尼的获批均得益于“篮子试验”的研究结果。
“雨伞试验”是指对于不同基因突变导致的同种组织疾病,根据基因突变分类后用不同的靶向药物进行治疗,其最大优势在于将非常少见的突变事件集中起来,从而增加个体获得精准治疗的机会。
随着临床方案设计更加复杂,“篮子试验”和“雨伞试验”的边界也开始重叠。2015年,美国国家癌症研究所(NCI)启动了一项大规模的临床试验——选择治疗方案的分子分析(MATCH)计划(NCT02465060),动用全美国的卫生资源将抗肿瘤药物与肿瘤的基因特征相匹配,探索分子水平的异常能否有效指导抗癌药物的选择。NCI-MATCH试验由于筛查多种疾病人群被称为“篮子试验”,由于评价多种药物又被称为“雨伞试验”。NCI-MATCH试验使观察靶向药物对罕见肿瘤的反应性成为可能。
与“篮子试验”相比,“雨伞试验”进展相对缓慢,尚未取得突破性进展。2020年7月,一项目前规模最大的肺癌“雨伞试验”——英国“国家肺癌矩阵试验”(NLMT)公布了研究结果。NLMT试验还在继续进行中,尽管患者获益仍然存在不确定性,但是该试验为NSCLC精准药物治疗提供了一个可持续的平台,可在该平台上筛选潜在的新药物-生物标志物组合。
PROTACs技术为抗肿瘤精准药物研发带来新方向
蛋白降解靶向嵌合体(PROTACs)技术是近年发展的一种有效的内源性蛋白降解工具,通过泛素-蛋白酶体系统(UPS)将目标蛋白泛素化,从而实现蛋白水平调节。PROTACs技术在克服肿瘤耐药性、降解不可成药靶点以及降低靶点关联毒性(on-targettoxicity)等方面表现出巨大的优势,为抗肿瘤精准药物开发提供新的思路。截至2021年7月,全球范围内进入临床开发阶段的抗肿瘤PROTACs在研药物有4款。
随着PROTACs技术的发展,目前已经有50多个靶蛋白被成功降解,包括AR、ER、ALK、BCR-ABL、EGFR、FLT-3、PI3K、STAT3等,多数PROTACs分子尚处于临床前早期开发阶段。
此外,李华等开发出能够同时降解2个完全不同通路靶点的双重靶向降解分子(DualPROTACs),能够在细胞水平成功地同时降解癌细胞内的EGFR和PARP蛋白。DualPROTACs有可能达到类似双特异性抗体药物的疗效,并仍然保持小分子药物的优点。
结论
“精准医学”时代下,疾病的治疗方式悄然发生着变化,尤其是肿瘤治疗领域。针对基因突变对患者进行细分,从而选择最合适的人群,已经成为当前抗肿瘤药物开发的常见模式。
精准靶向疗法、细胞治疗、免疫疗法的出现,大大提升了肿瘤患者的5年生存率以及生活质量。尽管抗肿瘤精准药物的出现给部分肺癌、乳腺癌、黑色素瘤和白血病患者带来了希望,但大多数肿瘤依然缺乏特异性的治疗方法。
肿瘤分子特征分析及更多肿瘤驱动基因的发现和鉴定仍是未来抗肿瘤精准药物发展的基础。以“篮子试验”和“雨伞试验”为代表的新型临床试验设计,以及来自患者的真实世界数据收集和分析,将进一步推动抗肿瘤精准药物发展。
此外,PROTACs和分子胶(molecularglue)等新技术的出现,使未来开发克服耐药或针对“不可成药靶点”的靶向药物成为可能。完善创新治疗药物与肿瘤患者人群的精确匹配,实现以基因组信息为导向的精准治疗是精准药物开发的新方向。
论文全文发表于《科技导报》2022年第13期,原标题为《肿瘤精准药物治疗研究进展》
本文有删减,欢迎订阅查看
本文链接:https://goko.jsntrg.cn/208271174296.html
